7月CDE生物制品药审报告
看点
•7月药审中心受理总量为1409个
根据药智数据企业版——药品注册与受理数据库最新统计,2023年7月份CDE共承办新的药品注册申请以受理号计有1409个(数据统计时间截止8月9日,下同),其中化药受理1005个,中药受理210个,生物制品受理193个;2023年2-7月各类药品注册申请受理情况详见图1。
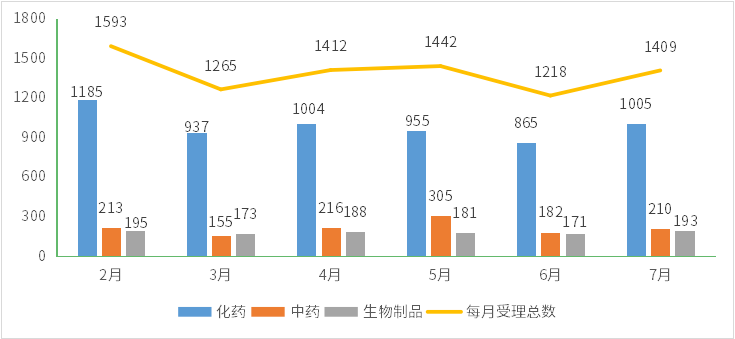
图1 2023年2-7月CDE药品受理情况
2023年7月份(注:状态开始时间(药智)从2023年7月1日至2023年7月30日)完成审评的受理号共1253个,其中化药受理851个,中药受理215个,生物制品受理185个;2023年2-7月各类药品完成审评情况详见图2。
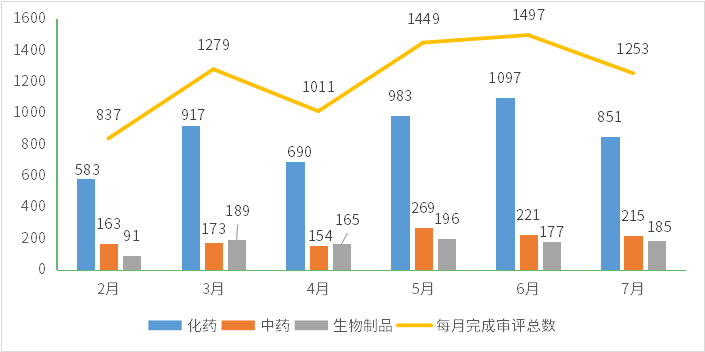
图2 2023年2-7月CDE药品完成审评情况
生物制品审评情况
(一)生物制品受理情况
7月份CDE承办新的生物制品注册申请受理号共计193个,新药90个,补充申请61个,进口37个,进口再注册2个,一次性进口3个;2023年2-7月CDE生物制品各申请类型受理情况详见图8。
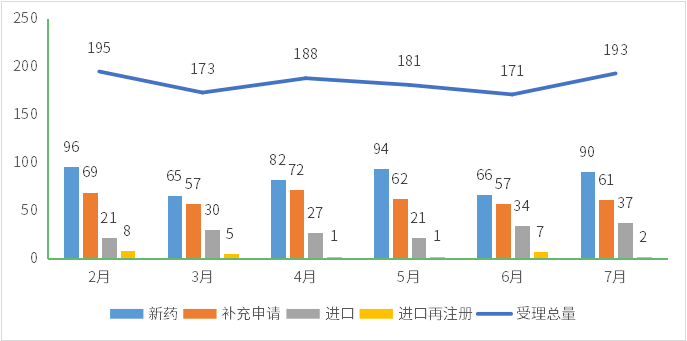
图8 2023年2-7月CDE生物制品各申请类型受理情况
生物制品1类新药申报情况
7月共84个生物制品1类新药受理号获得承办,均为临床试验申请,目前都已进入相应序列排队待审;下表为7月新承办的生物制品1类创新药。
表7 2023年7月新承办的生物制品1类新药
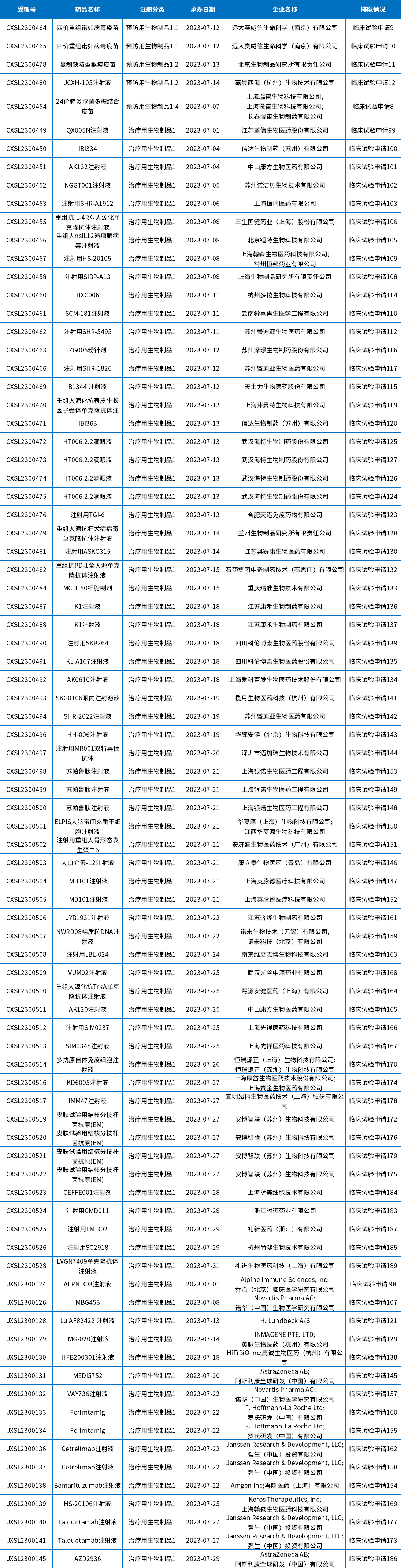
注:排队序号截止至2023年08月09日
(二)生物制品完成审评情况
7月份CDE完成审评的生物制品注册申请185个(以受理号计),其中新药申请受理号88个,进口受理号24个,补充申请62个;以审评任务类别统计(以受理号计),临床试验申请106个,上市申请6个;2023年7月CDE生物制品各审评任务类别完成审评情况详见图9;
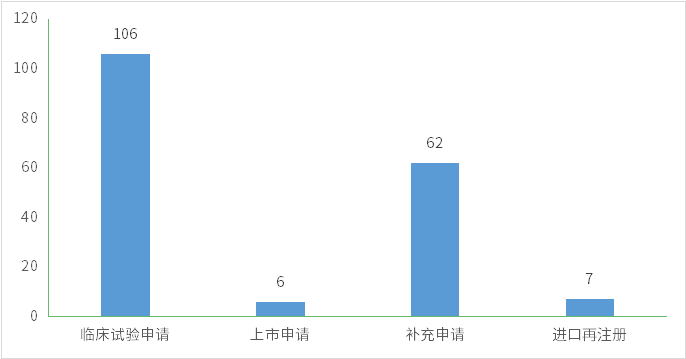
图9 2023年7月CDE生物制品各审评任务类别完成审评情况
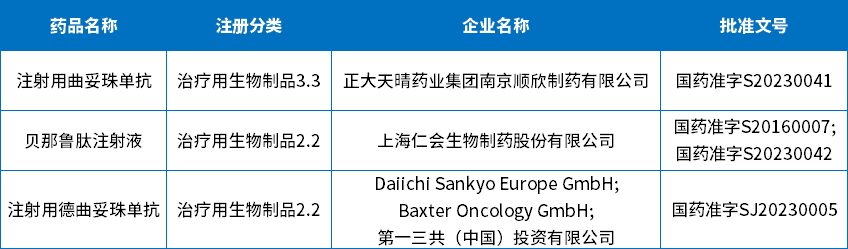
在受理号审评结论方面(结论数据统计截止2023年08月09日):批准临床118个,批准生产3个,批准进口1个,批准再注册7个,未被批准5个;下表为7月生物制品批准上市信息。
表8 2023年7月生物制品获批信息
数据来源:药智数据企业版——药品注册与受理数据库

用户登录
还没有账号?
立即注册