张荣/袁正宏/蔡启良等揭示新冠病毒入侵机制及传染性研究进展
2021-04-06
目前新冠病毒在全球引起超过1亿人感染病例,这与2003年非典病毒(SARS-CoV)感染不到1万病例形成鲜明对比。相比非典病毒的致病性,新冠病毒较轻,但潜伏期长,无症状感染者多,传染性似乎也更强。两者核苷酸序列具有近80%同源性,使用相同细胞受体血管紧张素转换酶2(ACE2)入胞[1,2]。新冠病毒编码的刺突蛋白(spike, S)通过结合细胞受体入胞,决定宿主嗜性和致病性等。值得注意的是,新冠病毒的S蛋白与SARS-CoV的S蛋白比较,在S1和S2亚基的切割位点有多个碱基氨基酸(RRAR)[3]。关于为何有这几个碱性氨基酸的神秘插入,它在病毒感染过程中所发挥的作用是大家研究的热点。研究表明,该位点可以被位于高尔基体的弗林酶(Furin)所切割,释放的新生病毒再次入胞时,可能减少了对位于细胞质膜上的蛋白酶如跨膜丝氨酸蛋白酶2(TMPRSS2)的依赖性,有效促进病毒感染[4]。而切割后形成的“RRAR”末端即所谓的C-end rule (CendR),可以被Neuropilin-1(NRP1) 识别,有助于病毒的感染入侵[5,6]。
通常,冠状病毒的入胞可以通过病毒颗粒与细胞质膜的直接膜融合进入,位于细胞质膜的丝氨酸蛋白酶如TMPRSS2或者外源蛋白酶如Trypsin 等会触发质膜融合途径,该途径更直接高效,称早期入胞途径[7]。病毒颗粒也可以通过内吞,在内体的组织蛋白酶L(CTSL)作用下,促使病毒囊膜与内体膜融合来释放基因组,该途径相对滞后,称晚期入胞途径。早期和晚期的入胞途径与细胞组织所表达的TMPRSS和CTSL有关。有研究表明,多碱性氨基酸的插入可以促进细胞间的膜融合,表达缺失了“RRAR”氨基酸序列的新冠病毒S蛋白引发的细胞膜融合程度显著降低[8,9]。这也提示了该碱性氨基酸序列可能调控病毒的入胞。
2021年2月11日,复旦大学上海医学院张荣/袁正宏/蔡启良等在Nature Communications杂志发表了题为A genome-wide CRISPR screen identifies host factors that regulate SARS-CoV-2 entry的研究论文。该研究揭示新冠病毒S蛋白的S1/S2亚基切割位点的碱性氨基酸序列调控病毒的入胞途径和传染性,并通过全基因组CRISPR筛选鉴定发现了一系列调控新冠病毒入胞的宿主因子,特别是调控病毒经内体入胞途径的相关因子。据悉,该研究在去年8月BioRxiv 预印版在线,题为The S1/S2 boundary of SARS-CoV-2 spike protein modulates cell entry pathways and transmission。

这项研究通过分离新冠病毒并在Vero E6细胞传代,获得一株不依赖胰酶的含S蛋白多碱性氨基酸缺失突变病毒。该缺失突变病毒在如低表达TMPRSS2但高表达CTSL的Vero E6和A549细胞上感染性显著增强,但在如高表达TMPRSS2低表达CTSL的Calu-3细胞上的感染性却降低。通过入胞途径的特异性药物抑制试验证明S蛋白多碱性氨基酸的缺失造成入胞途径由质膜融合向内体途径的转变(见图1)。
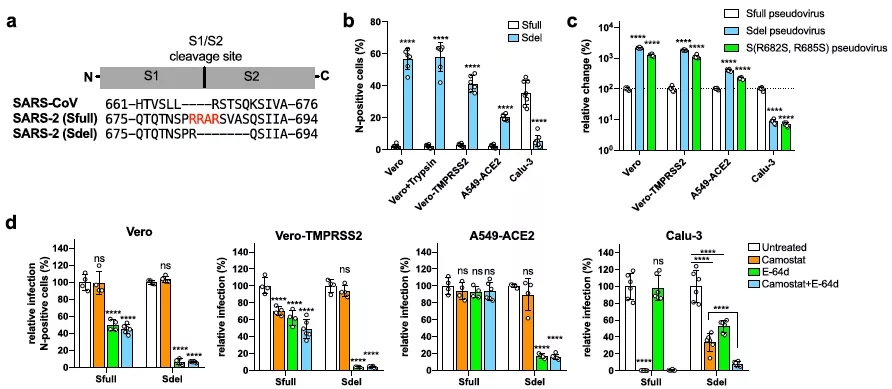
图1:新冠病毒S蛋白多碱性氨基酸缺失改变病毒的入胞途径
S蛋白多碱性氨基酸缺失突变病毒在A549-ACE2上的特异性内体入胞途径,为解析病毒的入胞机制提供了良好的研究工具。为深入揭示新冠病毒内体入胞途径的调控机制,作者进行了全基因组CRISPR筛选,鉴定发现一系列与内体货物转运相关的复合体如Retromer、CCC、WASH、Arp2/3、WDR81/91和TFE3等,以及其它胆固醇转运相关基因如NPC1和NPC2等。进一步研究证实,这些宿主因子是对SARS-CoV-2、SARS-CoV和MERS-CoV的内体入胞途径至关重要的通用因子,而对不相关的VSV病毒入胞不重要。同时,该研究还发现一类调控细胞膜受体ACE2表达的宿主因子。
鉴于S蛋白碱性氨基酸位点调控病毒的入胞途径,而在人鼻和支气管组织中,决定膜融合入胞途径的蛋白酶TMPRSS2高表达[10,11,12],使病毒更有效的通过膜融合入胞建立感染,作者进一步假设S蛋白碱性氨基酸位点对病毒传染性的影响。基于建立的新冠病毒自然感染仓鼠小动物模型,作者系统的评价了S蛋白碱性氨基酸的缺失对在不同组织器官上感染的影响,结果显示缺失突变病毒均表现出较低的病毒载量。通过仓鼠密切接触传染性试验证明,S蛋白碱性氨基酸的缺失让病毒的传染性几乎丧失,这表明了S1 / S2附近的多碱基序列在病毒传播中发挥的关键性作用。
总的来说,该研究比较系统的探究了新冠病毒S蛋白碱性氨基酸的插入对病毒入胞途径以及传染性的影响,碱性氨基酸的缺失促使病毒由质膜融合向内体入胞的转变,并显著降低病毒的传染性。基于该碱性氨基酸缺失突变病毒的特异性内体入胞特性,通过全基因组CRISPR筛选,鉴定发现了一系列调控多种冠状病毒入胞途径的通用关键宿主基因(见图2)。该研究也解释了靶向内体入胞途径的抑制性药物如氯喹或者羟氯喹等的局限性[13,14,15],也为探究新冠病毒S蛋白多碱性氨基酸的自然获得、病毒进化与跨物种传播提供了启示。
值得注意的是,非典病毒SARS-CoV 的S蛋白S1/S2切割位点附近并没有碱性氨基酸的插入,与本研究的碱性氨基酸缺失突变病毒类似,一定程度上解释了SARS-CoV-2与SARS-CoV在传染性方面的差异。
通过全基因组CRISPR筛选以及其它高通量组学实验手段,对SARS-CoV-2等冠状病毒感染相关的宿主因子进行筛选鉴定,为认识病毒感染的生物学特性和靶向宿主的抗病毒药物研发提供重要基础。
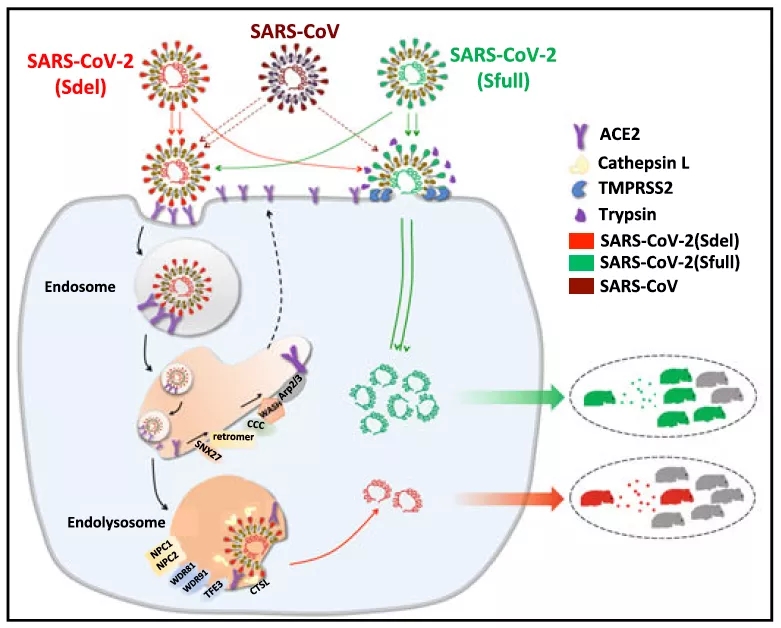
图2:新冠病毒S蛋白S1/S2位点的碱性氨基酸调控病毒入胞途径及传染性
复旦大学上海医学院基础医学院病原生物系的朱云凯、冯飞、胡高维和王玉燕为该论文的共同第一作者,张荣、袁正宏和蔡启良为共同通讯作者。复旦大学的谢幼华、瞿涤、朱园飞等,清华大学的丁强、南方医科大学的徐伟等,以及复旦大学生物安全三级实验室为课题提供了大力支持。
(来源:BioArt)
参考文献:
1. Zhou P, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, (2020).
2. Hoffmann M, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 181, 271-280 e278 (2020).
3. Wang Q, Qiu Y, Li JY, Zhou ZJ, Liao CH, Ge XY. A Unique Protease Cleavage Site Predicted in the Spike Protein of the Novel Pneumonia Coronavirus (2019-nCoV) Potentially Related to Viral Transmissibility. Virologica Sinica 35, 337-339 (2020).
4. Shang J, et al. Cell entry mechanisms of SARS-CoV-2. Proceedings of the National Academy of Sciences of the United States of America 117, 11727-11734 (2020).
5. Daly JL, et al. Neuropilin-1 is a host factor for SARS-CoV-2 infection. Science 370, 861-865 (2020).
6. Cantuti-Castelvetri L, et al. Neuropilin-1 facilitates SARS-CoV-2 cell entry and infectivity. Science 370, 856-860 (2020).
7. Tang T, Bidon M, Jaimes JA, Whittaker GR, Daniel S. Coronavirus membrane fusion mechanism offers a potential target for antiviral development. Antiviral research 178, 104792 (2020).
8. Hoffmann M, Kleine-Weber H, Pohlmann S. A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells. Molecular cell 78, 779-784 e775 (2020).
9. Xia S, et al. The role of furin cleavage site in SARS-CoV-2 spike protein-mediated membrane fusion in the presence or absence of trypsin. Signal transduction and targeted therapy 5, 92 (2020).
10. Qi J, et al. The scRNA-seq Expression Profiling of the Receptor ACE2 and the Cellular Protease TMPRSS2 Reveals Human Organs Susceptible to SARS-CoV-2 Infection. Int J Environ Res Public Health 18, (2021).
11. Sungnak W, et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature medicine 26, 681-687 (2020).
12. Sungnak W, Huang N, Bécavin C, Berg M, Network HCALB. SARS-CoV-2 Entry Genes Are Most Highly Expressed in Nasal Goblet and Ciliated Cells within Human Airways. ArXiv, arXiv:2003.06122v06121 (2020).
13. Hoffmann M, et al. Chloroquine does not inhibit infection of human lung cells with SARS-CoV-2. Nature, (2020).
14. Boulware DR, et al. A Randomized Trial of Hydroxychloroquine as Postexposure Prophylaxis for Covid-19. New England Journal of Medicine, (2020).
15. Kupferschmidt K. Big studies dim hopes for hydroxychloroquine.

用户登录
还没有账号?
立即注册